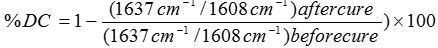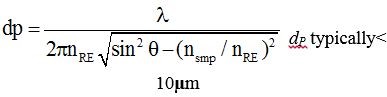آزمایشگاه طيف سنجي
FTIR,CHNOS
1-1 مقدمه
يكي از بهترين و مناسبترين روشهاي مطالعه ساختار اتمي مواد، طيف بيني است. در طيف بيني بر هم كنش تابش الكترومغناطيسي با ماده مورد مطالعه قرار ميگيرد. طيف الكترومغناطيسي گستره وسيعي از طول موجها را در بر ميگيرد و كليه روشهاي طيف بيني براي شناسايي، تعيين مقدار، مكانيسم واكنش،ساختار ملكولي، خواص فيزيكي و شيميايي و پايداري مواد بكار ميرود. آزمون FTIR در ناحيه مياني يعني گستره طيفي 1-cm400- 4000 شامل روشهايي مفيد براي آناليز کيفي و كمي مايعات و جامدات است. خروجي دستگاه FTIR، نمودار جذب يا عبور نور بر حسب عدد موجي ميباشد.
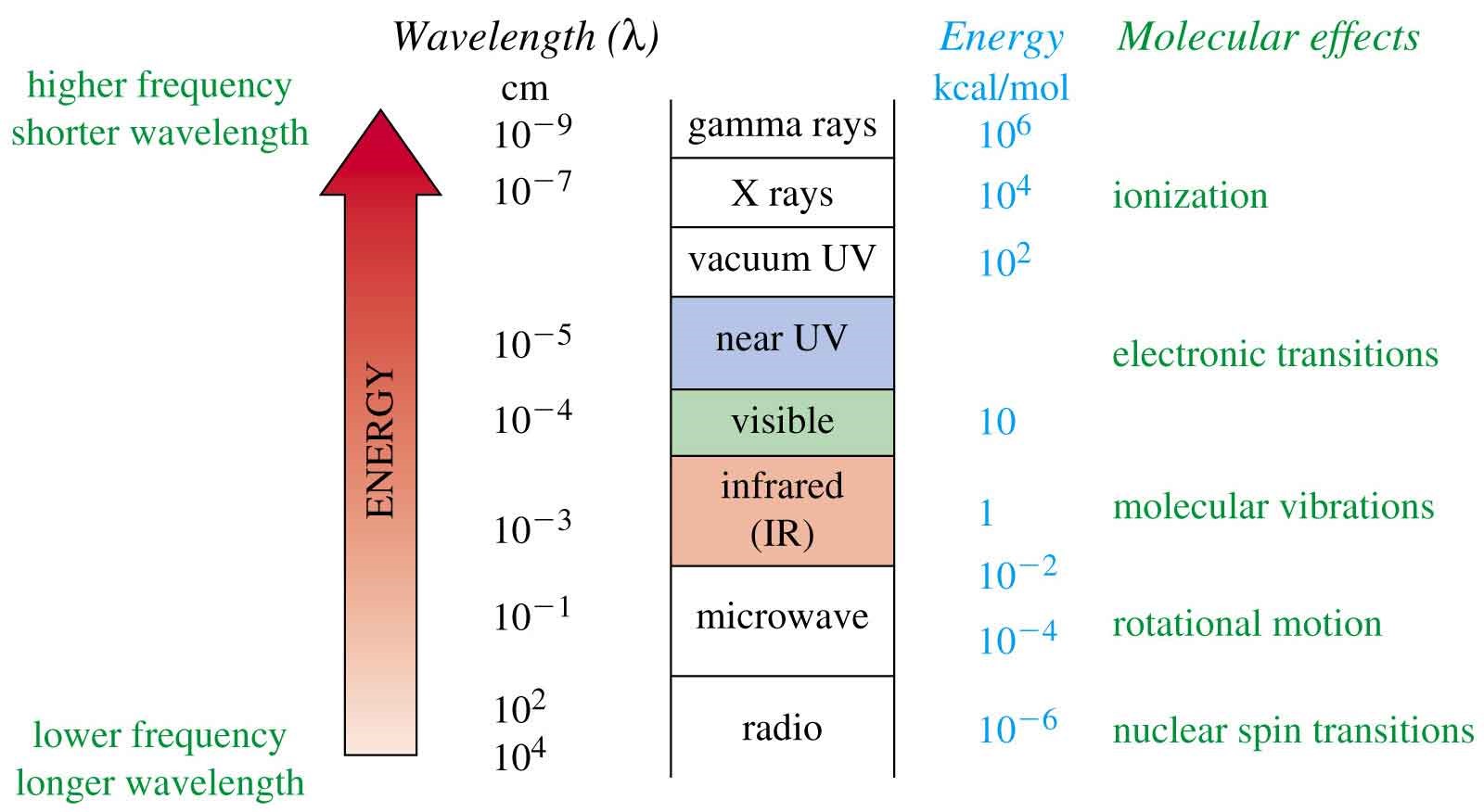
2-1 نواحي مختلف امواج الكترومغناطيس كه براي كاربردهاي تجزيه اي به كار مي روند و نام روشهاي مربوط به آن ها در شكل زير آمده است:
شکل1: امواج الکترومغناطیسی و انرژی و طول موج های مربوطه
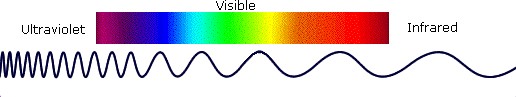
شکل 2: محل قرارگیری نور زیر قرمز
ناحيه زير قرمز: ناحيه زير قرمز از طيف الكترومغناطيسي از انتهاي ناحيه نور مرئي شروع و تا ابتداي ناحيه ميكروويو خاتمه مي يابد .اين ناحيه نيز به سه دسته نزديك و مياني و دور تقسيم ميشود.
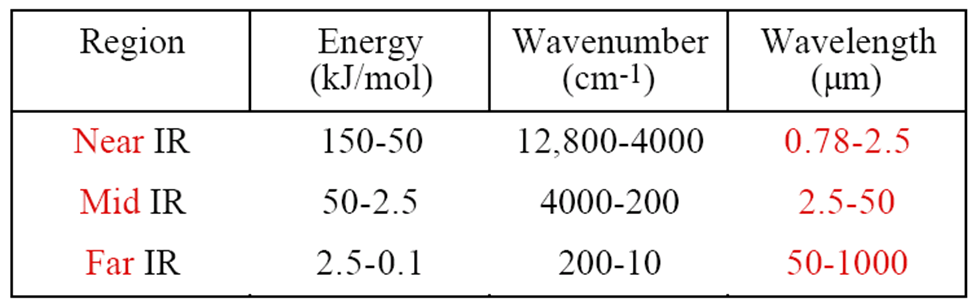
جدول 1 : نواحی مختلف نور زیر قرمز و انرژی و عددموجی و طول موج های مربوطه
ناحيه مياني طيف مادون قرمز در محدوده عدد موجي Cm-1 200-3600 است و انرژي مربوط به اين ناحيه mol-1 5/2 -50 است كه اين انرژي براي تغييرات چرخشي و ارتعاشي مولكولي كافي است.
يك مولكول در صورتي تابش IR را جذب ميكند كه تغيير حالات ارتعاش آن مربوط به تغييري در ممان دو قطبي مولكول باشد. به عبارتي ارتعاشاتي در IR فعال است كه ممان دو قطبي مولکول، در اثر تابش IR تغيير كند. ارتعاشاتی که در اثر برخورد نور با ماده بوجود می آید شامل:
3-1 انواع ارتعاشات مولکولی
1- کششی
2- خمشی
در ارتعاشات كششي ، طول پيوند بين اتمها تغيير مي كند و فاصله اتمها در امتداد پيوند كم و زياد ميشود، که خود به دو دسته کششی متقارن و کششی نامتقارن تقسیم بندی میشود.
در ارتعاشات خمشي، زاويه هاي پيوندي بين اتمهاي مولكول تغيير ميكند. انرژي لازم براي اينگونه ارتعاشات كمتر از ارتعاشات كششي است.
فركانس ارتعاش طبيعي اكثر مولكول هاي آلي وبعضي از مواد معدني درناحيه فركانس هاي زير قرمز قرار دارد. فركانس به جرم اتم ها و ثابت نيروي بين آنها بستگي دارد و اغلب تحت تاثير آرايش فضايي گروههاي شيميايي موجود در مولكول می باشد. لذا هر مولكول يك سري فركانس هاي ارتعاشي مخصوص به خود دارد كه متفاوت از فركانس ارتعاشي ملكول هاي ديگر است.
اگر فركانس ارتعاشي طبيعي برابر با فركانس اشعه تابيده شده باشد عمل رزونانس صورت ميگيرد و انرژي جذب ميشود. طيف سنجي زير قرمز مقدار جذب و يا مقدار عبور نور از نمونه را بر حسب عدد موجي اندازه گيري نموده و نتايج حاصله را به صورت يك طيف ثبت مينمايد.
4-1 طريقه محاسبه عدد موجي يا انرژي ارتعاشي يك مولكول دو اتمي به طريق زير است:
كه k ثابت فنر ، µ جرم کاهش یافته و m1 , m2 جرم ملكولي هر يك از اتمها و C سرعت نور است.
5-1 منبع نور: در انواع تجاري سه نوع منبع نرست، گلوبار و سيمهاي ملتهب به كار ميروند.
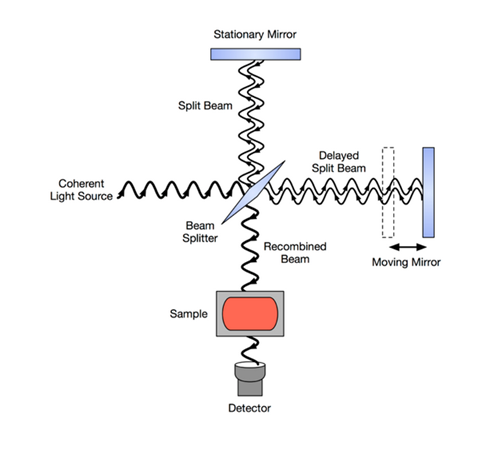
6-1 آشكار ساز: از آنجاييكه سرعت طيف گيري در زمان پويش FT فوق العاده سريع ميباشد از آشكارسازهاي IR معمولي به علت كندي و كم بودن حساسيت آنها نميتوان استفاده كرد.
آشكارساز حرارتي پيرو الكتريك (DTGS) بعلت سرعت عمل و حساسيت بالا متداولترين آشكارساز مورد استفاده در FTIR است.
تابش خروجي از نمونه پس از برخورد با آشكارساز به سيگنال هاي الكتريكي تبديل مي شود به مجموعه اين سيگنالهاي اندازه گيري شده كه داراي شدت هاي متفاوتي بوده و به صورت تعداد زيادي نقاط در حافظه كامپيوتر ضبط ميگردند، تداخل نگاشت ميگويند. از آنجاييكه تداخل نگاشت شامل تعداد زيادي نقاط حاوي اطلاعات در قلمرو زمان است لذا قابل تغيير نميباشد. كامپيوتر با انجام محاسبات تبديل فوريه اطلاعات مربوط به تداخل نگاشت را به اطلاعات در قلمرو فركانس كه همان طيف است تبديل ميكند.
7-1 انواع روشهایFTIR
1-7-1 روش عبوری
در این روش پس از نمونه سازی، نمونه بطور مستقیم مقابل نورIR قرار میگیرد. اين دستگاه با تاباندن نور مادون قرمز باعث ارتعاش پیوندهای موجود در نمونه میشود. این ارتعاشات به دو صورت کششی و خمشی در پیوندها آشکار میشوند. در ایجاد ارتعاشات دو عامل اثر القاء و رزونانس تاثیر بسزایی در شدت یا ضعف ارتعاشات دارند. برای مثال اگر ترکیب دارای اثر رزونانس باشد در پیوندها راحتتر ارتعاش ایجاد شده و عدد موج نور تابیده شده کمتر ميشود. از طرف دیگر گروه ها و عناصر الکترونگاتیو و الکترون کشنده سبب میشود که ارتعاش سخت تر شده و عدد موج بالاتر رود.
چون این ارتعاشات سبب تخریب ساختار نمونه نمیشود می توان دوباره از نمونه استفاده کرد.
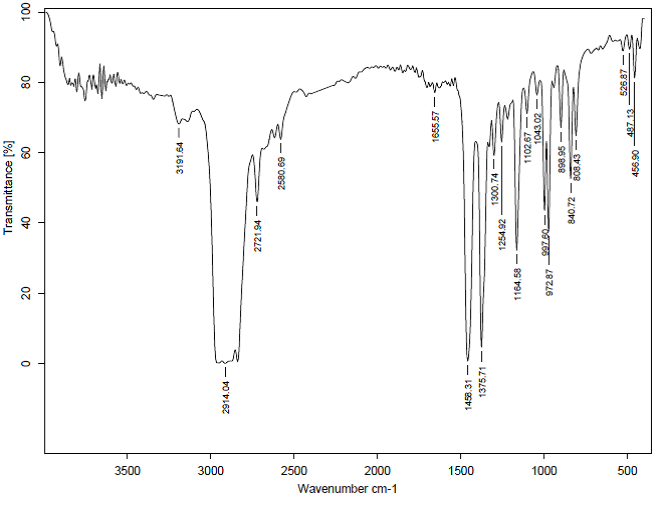
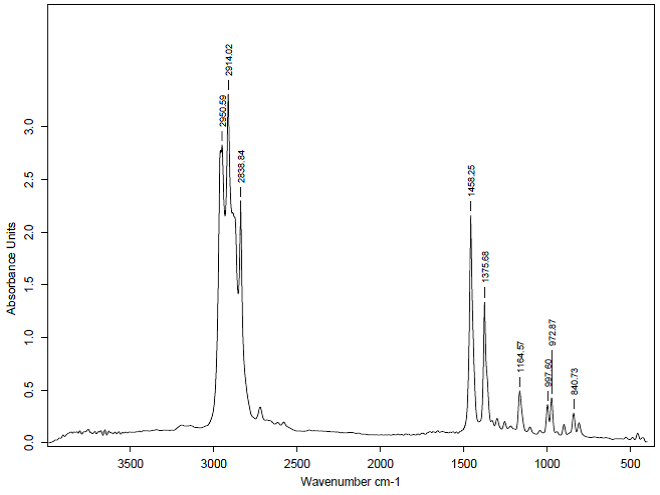
طيف FTIR چند نمونه :
شكل 3: طيفFTIR عبوري پلي پروپيلن
شكل 4: طيف FTIR جذبي پلي پروپيلن
شکل زیر قسمتهای مختلف داخل یک دستگاه FTIR را نشان میدهد.
شکل 5: قسمتهای داخلی دستگاه FTIR
2-7-1 روش انعکاسی:
در این روش نور از نمونه عبور نمی کند بلکه وارد سطح نمونه شده و به سمت منشور متعلق به دستگاه منعکس میشود. نور منعکس شده دوباره به سمت نمونه باز میگردد. توضیح بیشتر این قسمت در بخش سوم آورده شده است.
8- 1نمونه سازی
1-8-1 بررسی نمونه ها
بررسيهايي كه بر روي نمونه بايستي پيش از شروع كار انجام گردد عبارتند از:
1) نمونه ها آب و رطوبت نداشته باشند.
2) نمونه هاي فيلمي به صورت فيلم نازك و شفاف باشند تا نور به خوبي عبور كند. ضخامت نمونه نبايد از 50 ميكرون بيشتر باشد.
3) نمونه هاي پودري بايد، پودر ريز و خشك باشند.
4) در صورت لزوم نگهداري نمونه هاي پودري، قرص تهيه شده بايد در دسيكاتور قرار داده شود.
قرص به طور معمول براي مواد آلي بکار ميرود ولي براي چند نوع از مواد شيميايي محدوديتهايي وجود دارد. نمکهاي آميني، نمکهاي اسيد کربوکسيليک و چند ترکيب معدني ممکن است با نمکهاي هالوژنه واکنش دهند ودر نتيجه، طيف اصلي نمونه به دست نيايد.
چون طيف به اندازه ذرات وابسته است لازم است که نمونه و مواد مرجع به يک روش تهيه شوند تا توزيع ذرات تکرار پذير باشد. بايد توجه شود که ساختار کريستالي يک ترکيب ممکن است با سايش يا با فشار بالا تغيير کند و در طيف IRتغييري بوجود آيد.
نمونه و پودر نمک هالوژنه بايد خشک باشند تا قرص شفافي حاصل شود.
2-8-1 تهیه قرص از نمونه پودر
معمولاً نسبت کمي نمونه بسته به نوع نمونه 50 :1 تا 1:100 به پودر برميد پتاسيم اضافه مي شود. براي تهيه قرص از يک هاون استفاده ميشود تا اندازه ذرات کوچکتر شده و پراکندگي نور IR به حداقل برسد. هاون بايد سطح صيقلي داشته و ازجنس عقيق باشد. برميد پتاسيم بتدريج به نمونه اضافه ميشود و بطور کامل با آن مخلوط ميشود.
مخلوط نمونه و برميد پتاسيم در يک قالب مخصوص پرس ميشود. مقدار نيروي بکار رفته براي پرس بستگي به قطر و ضخامت قالب دارد. ولي معمولا" 10-8 تن فشار مناسب است.
بهترين قرص با تخليه هوا داخل قالب حاوي مخلوط نمونه و برميد پتاسيم قبل از اعمال فشار بدست ميآيد. اين روش مقدار رطوبت در قرص پرس شده را به حداقل ميرساند.
3-8-1 نمونه های مایع
براي تعيين طيف مايعات غير فرار ميتوان از قرص يکبار مصرف پتاسيم برميد استفاده كرد. يک قطره خيلي کوچک، معمولاً کمتر از 10 ميکرو ليتر از مايع بر روي قرص چكانده مي شود. بايد توجه کرد که در اين روش هر جزء فراري در مخلوط تبخير شده واز دست خواهد رفت.
4-8-1 روش محلولي
آناليز مواد محلول درحلال شفاف در برابر IR (روش شکافتگي حلال): بسياري از نمونه هاي جامد و مايع در حلال هايي که در نواحي IRشفاف هستند، محلول ميباشند. اين حلالها شامل: تتراكريدكربن، كلروفرم، متيلن كلرايد، كربن دي سولفيد، استو نيتريل، استون،دي متيل سولفوكسايد ميباشد.
5-8-1 انتخاب حلال به چند فاکتور بستگي دارد.
1- نمونه تحت آزمون بايد به حد کافي حلاليت داشته باشد.
2- نبايد با حلال وارد واکنش شود.
3- حلال بايد در نواحي که نمونه جذب دارد، جذب نداشته باشد.
مشخصات دستگاههای FTIR موجود در پژوهشگاه پلیمر و پتروشیمی ایران:
بخش دوم : کاربردهای FTIR
1-2 كاربردهای کیفی
شامل تعیین گروه عاملی مواد، تعیین خلوص، شناسایی مواد معدنی و تعیین ساختار آنها، شناسایی پلیمرها، کریستالوگرافی.
به عنوان مثال روش شناسایی یک نمونه پلی آمید شرح داده می شود:
1-1-2 شناسایی پلی آمیدها:
مهمترين روش شناسايي پليآميدها از طريق طيف IR ، شناسايي باندهاي ايجاد شده در اثر گروههاي آميدي است به خصوص باند حدود (1-cm3300) مربوط به پيوند كششي آميدهاي نوع دوم و حدود
(1-cm1634-1650) مربوط به ارتعاش كششي گروه كربونيل و باند حدود (1-cm1541-1550) مربوط به ارتعاش خمشي N-H. لازم به ذكر است كه اين پيوندها به تنهايي براي تشخيص پليآميدها از ساير گروههاي آميدي نوع دوم مثل پروتئينها، اوره ها و رزين هاي فرمالدئيدي كافي نيست.
جدول ذيل گروههاي عاملي و محل جذب مربوط به آنها را در پلي آميدها نشان ميدهد:
2-2 كاربردهاي كمي طيف بيني زير قرمز: اهميت اين كاربرد از كاربرد كيفي كمتر است.
1-2-2 استفاده مستقيم از رابطه بير لامبرتA = ɛ b c
كه A ميزان جذب نور،ɛ، ضريب جذب مولار و c غلظت نمونه ميباشد.
2-2-2 روش اندازه گيري خط پايه
كه با استفاده از محاسبه خط پايه ميتوان سطح زيرپيك هر نمونه را محاسبه كرد و با توجه به سطح زير پيك روند پيشرفت واكنش را محاسبه كرد.
3-2-2 روش افزايش استاندارد
4-2-2 استفاده از منحني كاليبراسيون: در اين روش نمونه با غلظتهاي مشخص ساخته و جذب نمونه ها با استفاده از دستگاه، اندازه گيري ميشود و نمودار A برحسب C (منحني كاليبراسيون) رسم شده، سپس جذب نمونه مجهول خوانده ميشود و با توجه به منحني كاليبراسيون غلظت نمونه مجهول به دست ميآيد.
5-2-2 محاسبه درجه تبديل در پخت نوري
در شكل زير، طيف هاي FT-IR براي نمونه هاي %0 و %5 نانوخاك رس پیوند شده با پلي متيل متا اكريلات نشان داده شده است. با استفاده از اندازه گيري ميزان جذب در اعداد موجي cm-1 1608وcm-1 1637 قبل و بعد از پخت مي توان درجه تبديل را محاسبه كرد.
شكل بالا طيف مربوط به نمونه حاوي نانوخاك رس پیوند شده، بعد از پخت (خط چين)، قبل از پخت (خط كامل) میباشد که جذب در اين فركانسها مربوط به باندهاي دوگانه است. با پيشرفت واكنش پليمرشدن در هنگام پخت نوري ، يا به طوركلي طي پليمر شدن مونومرهاي چند عاملي، به علت پديده كنترل نفوذي تمام باندهاي دوگانه متاكريلاتي به پليمر تبديل نمي شوند و تقريباً %40-30 گروههاي متاكريلاتي به صورت واكنش نداده در پليمر باقي مي مانند. درجه تبديل، درصد باندهاي دوگانه مصرف شده را نشان ميدهد. در واقع نسبت جذب در دو عدد موجي cm-11637 به cm-1 1608، معياري از باندهاي دوگانه مصرف شده میباشد. درجه تبديل به چند فاكتور از جمله تركيب ماده، عبور نور از ماده، ميزان فعال كننده و شروع كننده واكنش بستگي دارد.
معمولا وقتي درجه تبديل از 60% بالاتر باشد، پخت كامل در نظر گرفته ميشود.
بخش سوم : ATR
1-3 روش انعكاسي يا روش بازتابش كل تضعيف شده ATR
شکل 10: شمایی از روش ATR
در اين روش يك طيف بازتابشي كه بسيار شبيه طيف جذبي است بدست ميآيد.
اساس اين روش بازتابش داخلي كل نور بين سطوح داخلي دو محيط با ضريب شكستهاي متفاوت است. نمونه اي كه طيف آن بايد گرفته شود، مجاور سطحي از منشور كه در آن بازتابش داخلي رخ ميدهد قرار ميگيرد و براي ايجاد حداكثر تماس با سطح منشور به آن فشار وارد مي شود.
ايجاد تماس خوب بين سطح منشور و نمونه از عوامل بسيار مهم ميباشد. طيف ATR نمونه هايي كه سطح يكنواخت نداشته و سخت و شكننده هستند با نويز بسيار زيادي همراه ميباشد.
نمونه بازتابش نور از يك سطح را به گونهاي كاهش ميدهد كه طيف بدست ميآيد. اين طيف شباهت زيادي به طيف عبوري خواهد داشت مشروط بر اينكه تماس خوبي بين سطح منشور و نمونه برقرار شود.
براي اينكه اين روش موثر باشد بايد تفاوت زيادي بين ضريب شكست نمونه و منشور باشد.
رايجترين نوع منشور، تاليوم برمو يدايد با ضريب شكست 4/2 است. زيرا به علت استحكام زياد ميتواند فشار لازم براي ايجاد تماس مناسب بين نمونه و منشور را تحمل كند. انواع ديگر عبارت است از كلريد نقره و برميد نقره با ضريب شكست 2 و سلنيد روي با ضريب شكست 4/2 و ژرمانيم با ضريب شكست 4 و الماس. طيف حاصل از روش ATR بسيار شبيه به طيف عبوري از نمونه است با اختلاف جزئي. دليل اين اختلاف تفاوت ميزان عمق نفوذ اشعه به نمونه است. عمق نفوذ در طول موجهاي كوتاه كمتر از عمق نفوذ در طول موجهاي بلند تر است و بنابراين هر چه به سمت طول موجهاي بلندتر ميرويم افزايش نسبي در شدت پيكها مشاهده ميشود.
يكي ازكاربردهاي مهم اين روش شناسايي فيلم هاي چند لايه و روكش هاي سطح، فيلم هاي ضخيم و نمونه هاي مشكي است. براي لاستيكها و مواد شبيه آنان كه داراي مقدار زيادي دوده است از روشهاي ATR استفاده مي شود.
عوامل موثر بر طيف حاصل از روش ATR عبارتند از فشار، سطح نمونه و ضريب شكست نمونه.
مزاياي استفاده از روش ATR شامل :
1- آناليز نمونه هاي چند لايه
2- آناليز سطح نمونه
3- آناليز نمونه هاي تيره رنگ مانند لاستيك ها
4- عدم نياز به نمونه سازي
2-3 محاسبه عمق نفوذ نور داخل نمونه
با استفاده از فرمول زیر می توان عمق نفوذ نور داخل نمونه را محاسبه نمود، که dp عمق نفوذ ، nRE ضریب شکست منشور، nsmp ضریب شکست نمونه، sinɵ زاویه نور ورودی میباشد.
با منشور سلنيد روي، ناحيه جوابدهي درمحدوده Cm-1650-4000 است و اين منشور مناسب محلولهاي اسيدي و بازي نيست بلكه براي محلولهايي كه pH آنها بين 5 تا 9 است كاربرد دارد.
3-3 مشخصات منشورهای متداول مورد استفاده در سیستمهای ATR در جدول صفحه بعد آمده است:
بخش چهارم : آنالیز عنصری
1-4 مقدمه
دستگاه آناليز عنصري دستكاه تمام اتوماتيكي است كه قادر است به سرعت مقادير كمي عناصر كربن، هيدروژن، نيتروژن و گوگرد را در محدوده 1/0 تا 100 در صد وزني تعيين كند. از اين دستگاه براي تعيين عناصر موجود در مواد شيميايي و دارويي، مواد مصنوعي، نفت، گاز، ذغال سنگ ، مواد رئولوژيكي، محصئلات كشاورزي و مواد غذايي استفاده ميشود.
اساس كار دستگاه آناليز عنصري، احتراق نمونه ها در دماي بالا و جدا سازي گازهاي ايجاد شده و آشكارسازي آنهاست.
2-4 الزامات دستگاه آناليز عنصري
از هر گونه آلودگی از جمله چربی پوست دست باید جلوگیری شود و در زمان بسته بندی کپسول ها با دست تماس نداشته باشند. هوای داخل نمونه باید حداقل مقدار باشد. این عمل با پرس کامل کپسول امکان پذیر است. نمونه باید کاملا خشک باشد زیرا وجود رطوبت در تعیین درصد عناصر خطا ایجاد میكند. به هنگام آماده سازی نمونه باید توجه کرد که هوا داخل آن محبوس نشده باشد زیرا در درصد نیتروژن خطا ایجاد میشود. هر گونه آلودگی که حاوی کربن و هیدروژن باشد نیز در نتیجه موثر است. با توجه به مقدار بسيار كم نمونه ضروري است كه از همگن بودن نمونه اطمينان حاصل كنيد. انتخاب مقدار نمونه با توجه به نوع آن است.
3-4 نمونه سازي
1-3-4 نمونه هاي پودري، ورق و فيلم
نمونه هاي پودري، ورق، فيلم و قطعات قالبگيري شده را خرد و يكنواخت كرده و بستگي به وزنش در ورقه قلع مخصوص توزين و سپس بسته بندي ميكنيم. برای مصارف خاص از فویل آلومینیم یا نقره نیز می توان استفاده کرد. برای آنالیز در مد CHNS/CNS/S افزایش پودر تنگستن تری اکساید WO3 به عنوان افزودنی معمول است.
2-3-4 نمونه هاي مايع
نمونه هاي مايع و خمیری را نيز در کپسول قلع بسته بندي ميكنيم.
3-3-4 انتخاب وزن نمونه
بهترین وزن بستگی به درصد عناصر، یکنواختی و چگونگی احتراق نمونه دارد. اگر نمونه شناخته شده باشد محدوده وزن را برای هر عنصر طوری انتخاب ميكنيم که مابین حداقل و حداکثر مقدار داده شده در کالیبراسیون باشد. شاخص اکسیژن را نیز متناسب با آن وزن انتخاب ميكنيم.
اگر نمونه ناشناخته باشد آزمون را با 5 تا 10 میلی گرم از نمونه انجام ميدهيم.
پس از وارد كردن وزن مورد نظر آن را در محفظه نمونه كه ظرفيت آن 79 نمونه است و به طور اتوماتيك
حركت ميكند، قرار مي دهيم. پس از حركت محفظه، نمونه در موقعيت مورد نظر نمونه از طريق شير غلطان وارد ستون احتراق ميشود.
4-4 انتخاب مقادیر شاخص اكسيژن
انتخاب نامناسب دوز اکسیژن باعث میشود که نمونه به طور كامل نسوزد و ash finger باقی مانده و نتیجه غلط شود. شاخص اکسیژن برحسب اعداد1 تا 5 تعیین میشود که به طور اتوماتیک متناسب با زمان پرژ گاز است. این اعداد بسته به نوع و وزن نمونه تعیین میشود.
برای احتراق معمولی دبی گاز اکسیژن ml/min25 -20 پیشنهاد میشود ولی برای مواد سخت سوز بسته به وزن نمونه مقدار اکسیژن ml/min35-30 است.
ابتدا چند نمونه به عنوان conditioning ميدهيم، سپس بسته به جواب، چند نمونه استاندارد ميدهيم تا ضريب تصحيح مشخص شده ودر جواب نمونههاي بعدي اعمال شود.
نمونه بعد از آماده شدن بايد در محفظه نمونه قرار داده شود و سپس نمونه به سمت كوره هدابت ميشود عناصر موجود در نمونه در لوله احتراق كه دماي آن قابل كنترل است با عبور گاز اكسيژن اكسيد ميشوند لوله احتراق از جنس كوارتز بوده و تا دماي 2800درجه سانتي گراد را تحمل ميكند. مواد پس از احتراق وارد لوله كاهش شده و پودر مس موجود در لوله عمل كاهش يا احيا را انجام ميدهد و اكسيژن اضافي گرفته ميشود نيتروژن موجود در نمونه پس از گرفته شدن اكسيژن اضافي مستقيماً به آشكار ساز حرارتي ميرسد سپس گوگرد به صورت SO2 و هيدروژن به صورت H2O و كربن به صورت CO2 به سمت ستون هاي جاذب SO2 و H2Oو CO2 هدايت ميشوند . سيستم به صورت جذب و واجذب عمل ميكند. در ستون هاي جذب با كاهش دما گازها جذب و با افزايش دما گازها واجذب ميگردد.
به عنوان مثال ستون SO2 در دماي 210درجه سانتي گراد گاز را دفع و در دماي 160 درجه سانتي گراد گاز را جذب كرده و در حالت پايدار دما نيز در همان دما است و به آشكار ساز حرارتي ميرسد. درمورد تعيين مقدار اكسيژن بهترين آشكار ساز نوع IR است ولي از آشكار ساز حرارتي نيز مي توان استفاده كرد.
گازهاي مورد استفاده هليم و اكسيژن با درصد خلوص 9996/99 مي باشد.
گزارش آزمون شامل وزن اوليه نمونه آزمون ، شاخص اكسيژن اعمال شده، در صد عناصر, H, N, S C در نمونه ، سطح زير پيك مربوط به آن عنصر ، فاكتور تصحيح و نسبتC/N است.
لازم به يادآوري است كه دستگاه آناليز عنصري اندازه گيري مطلق را انجام نميدهد. رابطه بين مقدارCHNS (ميلي گرم مطلق) ومقدار اندازه گيري شده (سطح زير پيك) توسط كاليبراسيون تعيين مي شود. اين عمل با مقادير مختلف نمونه هاي استاندارد و از طريق برنامه نرم افزاري به طور اتوماتيك انجام مي شود.
|
Aryanic webdesign توسط highportal aryanic